30. Bázisok - lúgos kémhatás
Ismétlés
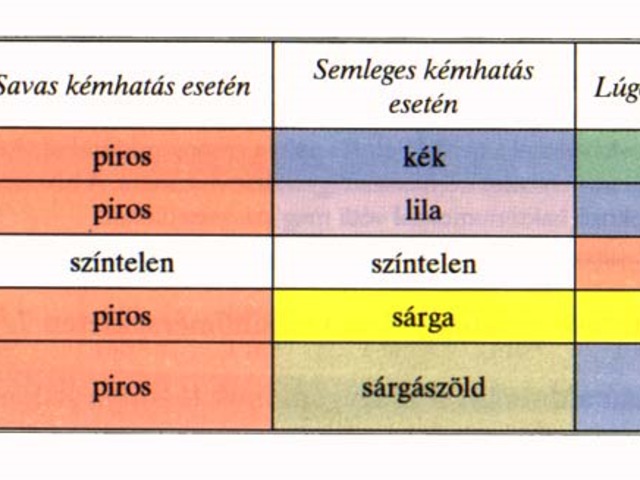
Előző órán megvizsgáltuk a különböző indikátorokat savakban és lúgokban. Emlékszel?
Milyen színűek az indikátorok lúgos kémhatású oldatokban?

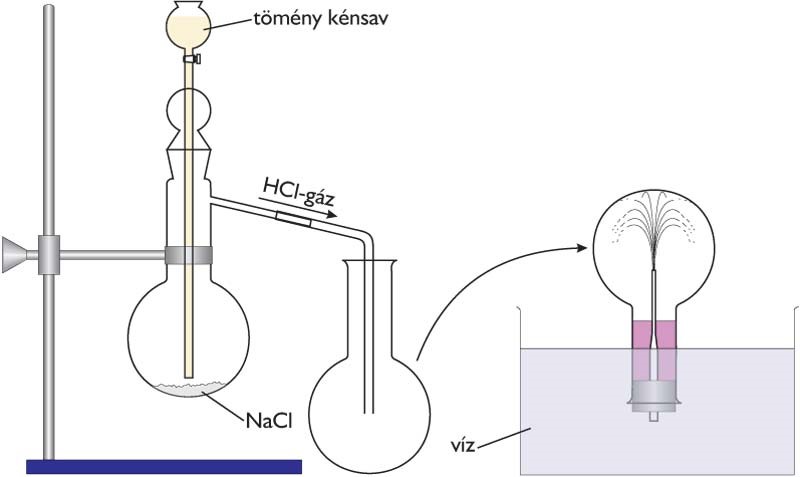
Idézzük fel, hogyan készítettünk sósav-szökőkutat! Segít az ábra:
Kedvcsináló durvaságok - miért kell ismerni a lúgokat?
Ammónia
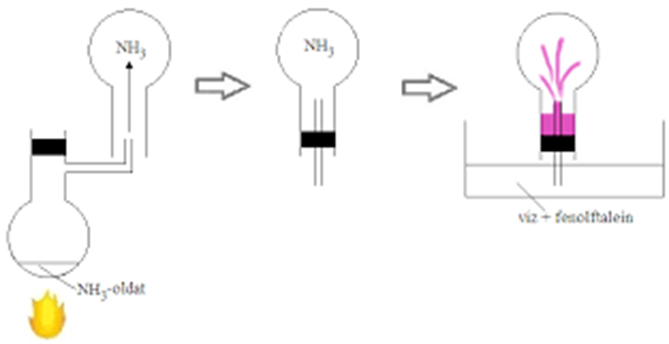
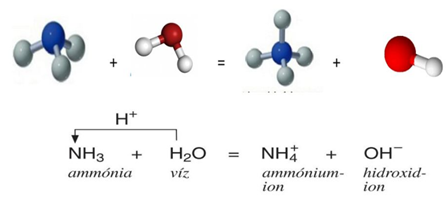
Az ábra alapján értelmezd az ammónia szökőkút kísérletet!
- Hogyan csináljuk?
- Mit tapasztalunk?
- Mi a magyarázat?
Készítsünk videót! Valaki narrálja az eseményeket, egy ember pedig rögzíti a kísérletet!
Kísérletek:
- Ammónia szökőkút (hasonlítsd össze a sósav - szökőkúttal! Learning Apps)
- NaOH kémhatása indikátorokkal
- Indikátor színváltozása hígításkor
Hipó és egyéb tisztítószerek
Talán takarítottál meg háztartási vegyszerekkel - remélhetőleg használtál hozzá kesztyűt. Ha mégsem, akkor érezhetted, hogy például hipózás után a bőröd milyen síkos: olyan, mintha mosogatószer maradt volna rajta. Ennek oka, hogy legtöbb háztartási vegyszerünk lúgos kémhatású, ami elroncsolja a bőrléceket (fehérjeroncsoló), ettől nem tapad az ujjunk.
Füzetvázlat: Bázisok - lúgos kémhatás
I. Közös jellemzők
- Síkos tapintásúak, mert fehérjeroncsolók
- Maró hatásúak
- Az indikátorok hasonló módon változtatják bennük a színüket
- A pH: 7-14
- Vízben hidroxid-ionra és fémionra disszociálnak (disszociál=ionokra esik szét)
- Értékűség: leadott hidroxidionok száma
II. Lúgos kémhatású anyagok: vizes oldatban megnövelik a hidroxid ionok mennyiségét
- Vízben oldódó hidroxidok (IA, II/A hidroxi vegyületei): NaOH, KOH, Ca(OH)2, Mg(OH)2
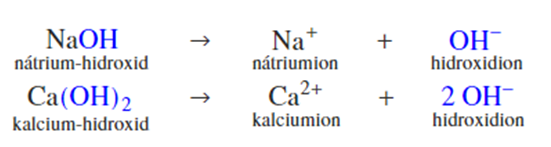
- Alkáliflmek (I/A) és alkáli-földfémek (II/A) vizes oldata: ezek vízben kémiailag oldódnak (reagálnak a vízzel):
2Na + 2H2O = 2NaOH + H2
Írd fel a K, Ca, Mg reakcióját vízzel!
3. Ammónia vizes oldata
- Az ammónia vízben kémiailag oldódik, vizes oldata a szalmiákszesz
- Az ammónia protont (hidrogén-iont) vesz át a víztől, hidroxid-ion keletkezik (összetett ion, mert több atomból áll)

III. Sav-bázis elméletek
Arrhenius:
- Sav: H+ ad le
- Bázis: OH- ad le
- Só: vízben kationra és anionra disszociálnak
- Disszociáció: megfordítható bomlás
- Savak értékűsége: megmutatja, hogy mennyi protont (H+) tud leadni a sav
Brönsted:
- Sav: olyan anyag, amely proton (H+) leadására képes.
- Egyértékű sav: olyan sav, amely egy proton (H+) leadására képes. Példa: sósav, ecetsav, salétromsav, kénsav
- Többértékű sav: olyan sav, amely több proton (H+) leadására képes. Példa: kénsav, szénsav, foszforsav
- Minden sav vizes oldatában vannak oxóniumionok, ezek hatására az indikátorok hasonlóan változtatják színüket. A savas kémhatást az oxóniumionok okozzák, pH-ja 7-nél kisebb
- Bázis: olyan anyag, amely proton (H+) felvételére képes.
- Egyértékű bázis: olyan bázis, amely egy proton (H+) felvételére képes.
- Többértékű bázis: olyan bázis, amely több proton (H+) felvételére képes.
- Minden lúgos oldatban vannak hidroxidionok, ezek hatására az indikátorok hasonlóan változtatják színüket. A lúgos kémhatást a hidroxidionok okozzák, pH-ja 7-nél nagyobb
A fontosabb ismeretekről itt találsz egy tanulást segítő feladatsort: MEGTANULOM!
Milyen kémhatásúak a különböző háztartási és vegyi anyagok? MEGOLDOM!